Uma equipa internacional, liderada por investigadores da Fundação Champalimaud (FC), demonstrou, pela primeira vez de forma realista, que poderá ser possível, no futuro, diagnosticar a doença de Parkinson (DP) anos mais cedo, através da realização de exames cerebrais com ressonância magnética funcional (IRMf). Embora existam opções de tratamento após o diagnóstico, não existe cura. As terapias estão em constante evolução. As terapias estão em constante evolução, com investigações em curso que visam abrandar, ou até alterar, o curso da doença, é fundamental investir na investigação de métodos que permitam um diagnóstico mais precoce. A detecção antecipada poderá permitir que os tratamentos venham a ser aplicados quando têm um maior potencial de preservação da função cerebral.
Os resultados foram publicados hoje (8 de maio de 2025) no Journal of Cerebral Blood Flow and Metabolism. O estudo foi financiado pelo Prémio Mantero Belard, no valor de 200.000 euros, um prémio de neurociência atribuído pela Santa Casa da Misericórdia de Lisboa.
Já se sabe há algum tempo que parte das pessoas que estão a desenvolver, lentamente, a DP, mas que ainda são assintomáticas, se queixam da perda do olfato. Isso pode acontecer cinco a dez anos antes de ficarem realmente doentes e apresentarem todos os sintomas da doença: lentidão nos movimentos, tremores em repouso, rigidez e instabilidade postural.
A importância deste tipo de deficiência sensorial na DP não tem sido objeto de muita investigação. Além disso, embora muitas pessoas relatem perda do olfato, apenas algumas delas desenvolverão DP, o que significa que a deficiência olfativa por si só não é um biomarcador específico da doença. No entanto, o que também acontece é que as pessoas que desenvolvem DP, e doenças relacionadas, podem ainda ter défices visuais e até alucinações – e é aqui que poderá haver espaço para biomarcadores mais fiáveis.
Agora, pela primeira vez, Noam Shemesh (líder do laboratório de Ressonância Magnética Pré-clínica da CF) e a sua equipa – juntamente com Tiago Outeiro, neurocientista e especialista em Parkinson do Centro Médico Universitário de Göttingen – uniram esforços e demonstraram que a avaliação simultânea destas duas (e talvez outras) deficiências sensoriais no cérebro poderia fornecer um biomarcador robusto e precoce para a DP. E quanto mais precoce for o diagnóstico, maiores serão as hipóteses de desenvolver tratamentos eficazes para os doentes com DP.
Ressonância magnética funcional de ultra-alta resolução
Utilizando um scanner de ressonância magnética experimental de campo ultra-alto instalado no laboratório de Shemesh, os investigadores submeteram um modelo animal de ratinhos com DP a uma técnica chamada ressonância magnética funcional (IRMf). Para se ter uma ideia do poder da máquina experimental, esta gera um campo magnético de 9,4 Tesla (enquanto as máquinas de utilização clínica normalmente atingem apenas 3 Tesla). Isso melhora substancialmente as imagens obtidas e permite uma visão clara das estruturas cerebrais no pequeno cérebro do ratinho.
Os ratinhos transgénicos usados foram amplamente utilizados no laboratório de Outeiro e apresentavam níveis elevados de uma proteína humana chamada alfa-sinucleína. Pensa-se que esta proteína desempenha um papel importante na DP, uma vez que tende a acumular-se e a formar inclusões, incluindo na substancia nigra – a região do cérebro que produz dopamina e cuja degeneração progressiva é responsável pelas deficiências motoras na DP. «Os agregados de alfa-sinucleína espalham-se a seguir para outras regiões do cérebro e afectam as áreas motoras», explica Ruxanda Lungu, uma das primeiras autoras do estudo.
“Este modelo em ratinhos é muito útil”, diz Outeiro, “porque produz o tipo humano de alfa-sinucleína”. Além disso, o comportamento dos ratinhos denota uma perturbação do sentido do olfato – e também se pensa que estes animais sofrem de deficiência visual.
“A grande maioria dos estudos de IRMf em modelos animais tem-se focado num único sentido”, observa Shemesh. “Nós analisámos as modalidades sensoriais visual e olfativa, o que é bastante raro em experiências de IRMf.»
A ressonância magnética funcional é utilizada para ver quais as áreas do cérebro animal (ou humano) que são activadas em determinadas condições – neste caso, quando os animais são expostos a cheiros ou estímulos visuais. Nas imagens obtidas do cérebro inteiro, diversas áreas “acendem-se” em resposta à estimulação, devido a alterações no fluxo sanguíneo e na oxigenação impulsionadas pela actividade neural.
Os investigadores começaram por comparar, utilizando exames por IRMf, a actividade no cérebro de ratinhos vivos que produziam emaranhados de alfa-sinucleína com a de ratinhos dos mesmos progenitores que não os produziam. Os animais tinham cerca de nove meses de idade, o que corresponde a um estadio intermediário do desenvolvimento da DP.
E, de facto, as principais análises, conduzidas por Francisca Fernandes (também primeira autora do estudo), mostraram que os ratinhos do grupo de controlo apresentavam uma actividade normal nas áreas correspondentes do cérebro, enquanto nos ratinhos com DP havia muito menos actividade.
Separar o neural do vascular
No entanto, o problema com a IRMf é que “não detecta a atividade neural em si”, diz Shemesh. “Como depende das interacções entre a actividade neural e as propriedades vasculares, detecta uma combinação complexa de ambos os efeitos.” Ora, no presente estudo, era fundamental distinguir esses dois componentes para conseguir visualizar os efeitos puramente neurais da doença. “É muito, muito difícil fazer isso com a IRMf”, salienta Shemesh.
Por isso, a equipa teve de recorrer, também, a outras abordagens. A co-autora Sara Monteiro avaliou as propriedades vasculares com um método chamado “mapeamento do fluxo sanguíneo cerebral” e demonstrou que os efeitos vasculares eram realmente mais fracos nos ratinhos com DP em comparação com o grupo de controlo.
Em paralelo, Lungu mediu as contribuições neurais utilizando uma proteína chamada C-FOS, que é libertada quando um neurónio é activado. E ao analisar a quantidade dessa proteína presente (post mortem) no cérebro dos ratinhos com DP, descobriu que a redução da actividade neuronal era ainda mais pronunciada do que a do fluxo vascular. “Concluímos que, embora existam efeitos neuronais e vasculares, as alterações que observamos nas imagens de IRMf foram principalmente impulsionadas por efeitos neuronais”, afirma Shemesh. “Os neurónios dos ratinhos estavam simplesmente a disparar menos.”
Biomarcadores precoces para a DP?
“Tanto quanto sabemos, esta é a primeira observação de uma aberração sensorial visual e olfactiva conjunta na actividade cerebral de modelos de roedores com DP em geral e no modelo da alfa-sinucleína em particular”, escrevem os autores no seu artigo. «Isto oferece uma oportunidade para estudos futuros investigarem como os défices sensoriais progridem ao longo da doença – e talvez conduzam a biomarcadores de imagem precoces (...).”
“Partindo do princípio de que os efeitos da alfa-sinucleína no cérebro dos ratinhos e no cérebro humano são semelhantes, o que é uma suposição razoável, uma das coisas que poderíamos fazer agora seria analisar os sinais de ressonância magnética funcional no cérebro de pessoas que relatam algum tipo de anosmia [perda do olfato], bem como as suas respostas visuais”, explica Shemesh. “E se viéssemos a observar algo estranho em ambas as modalidades sensoriais, isso poderia significar que há algo mais global a acontecer nos circuitos neurais dessas pessoas e que precisamos de fazer um seguimento da situação.”
“A grande vantagem deste método é ser verdadeiramente não invasivo e fácil de realizar”, diz Outeiro. “Poderá vir a ser mais uma ferramenta para diagnosticar e classificar a DP, algo que é urgentemente necessário», acrescenta.
“Acho que este trabalho é uma boa primeira demonstração do facto de ser possível detectar deficiências multisensoriais no cérebro de forma bastante robusta”, conclui Shemesh. ”E isso dá-nos alguma esperança de que, em estudos futuros, surjam outros indicadores que também possamos observar, para determinar quais os tratamentos que podem ajudar se forem administrados precocemente.”
Lungu R, Fernandes FF, Pires Monteiro S, Outeiro TF, Shemesh N. Neural and vascular contributions to sensory impairments in a human alpha-synuclein transgenic mouse model of Parkinson’s disease. Journal of Cerebral Blood Flow & Metabolism. 2025;0(0). doi:10.1177/0271678X251338952
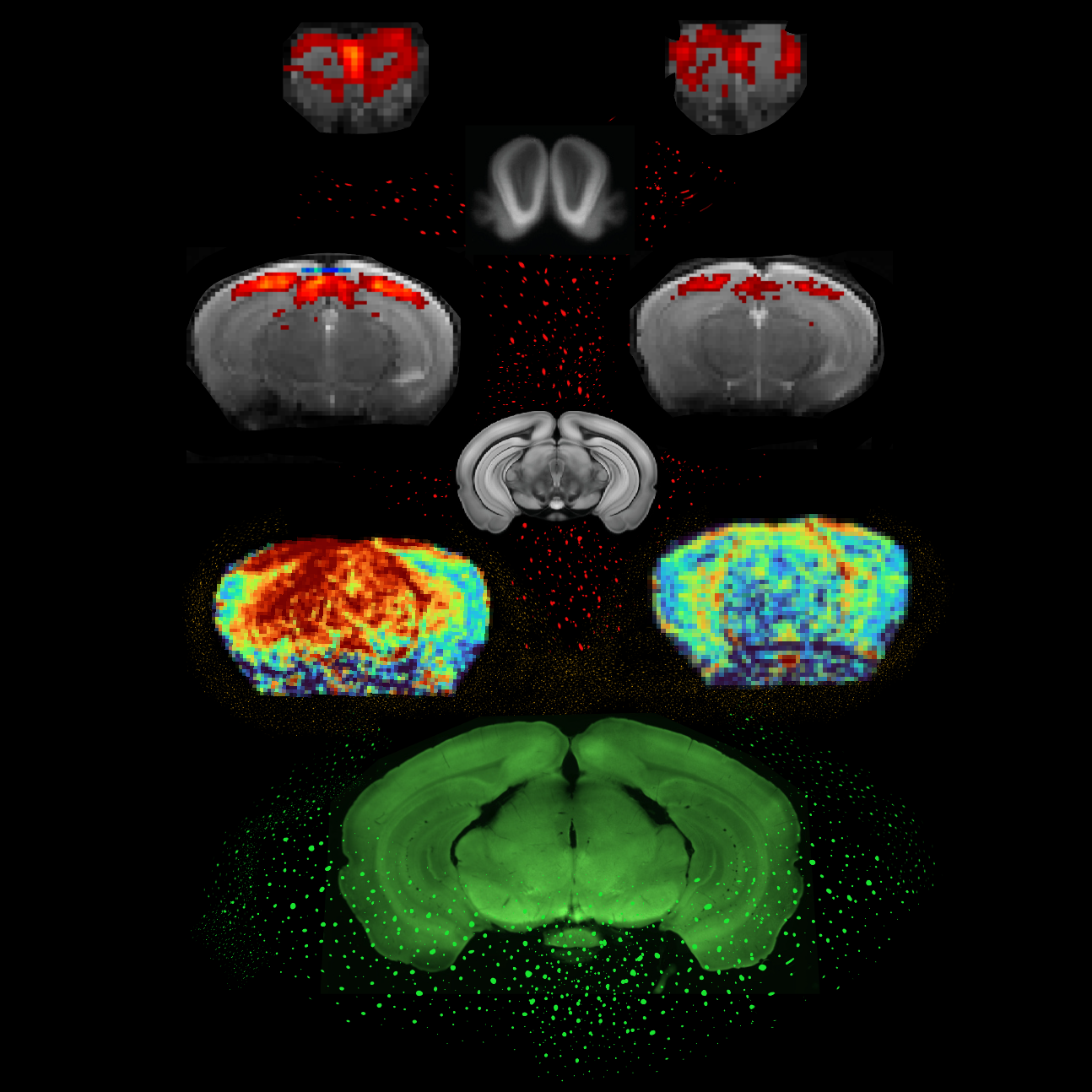
Legenda da Imagem
No cérebro de ratinhos de controlo (à esquerda) e de ratinhos com DP (à direita), de baixo para cima: actividade neuronal num animal representativo; mapeamento do fluxo sanguíneo cerebral; IRMf da estimulação visual; IRMf da estimulação olfativa. As imagens à esquerda e à direita são de IRM in vivo, enquanto as imagens no centro são de histologia ex vivo (Crédito: Ruxanda Lungu)
Texto de Ana Gerschenfeld, Health&Science Writer da Fundação Champalimaud.