Um novo interveniente no cancro do pâncreas
A equipa descobriu que algumas células do cancro do pâncreas ganham uma grande vantagem de sobrevivência ao transportarem cópias de genes essenciais do cancro – como o MYC – em fragmentos circulares de ADN que existem fora dos cromossomas (as estruturas que alojam a maior parte do nosso material genético). Conhecidos como ADNec (ecDNA em inglês), estes anéis genéticos flutuam livremente no núcleo da célula, permitindo que as células tumorais intensifiquem rapidamente a expressão dos genes do cancro, alterem a sua forma e sobrevivam em ambientes que de outra forma lhes seriam hostis.
“O cancro do pâncreas é frequentemente designado como um assassino silencioso porque é difícil de detectar até ser demasiado tarde”, diz Peter Bailey, coautor da pesquisa e responsável pela investigação translacional no Botton-Champalimaud Pancreatic Cancer Centre. “Sabemos que parte da sua letalidade decorre da capacidade de as células tumorais “mudarem de forma” quando submetidas a stress. O nosso estudo mostra que o ADNec constitui uma parte importante dessa história”.
Os investigadores descobriram que o ADNec é surpreendentemente comum nos tumores pancreáticos, em especial no caso de oncogenes como o MYC, que impulsiona o crescimento e o metabolismo do cancro. “Observámos uma variabilidade muito maior no número de cópias do gene MYC quando este se encontrava no ADNec”, explica Elena Fiorini, primeira autora do estudo. “Algumas células tinham dezenas – ou mesmo centenas – de cópias extra do MYC, o que lhes conferia uma grande vantagem de crescimento em determinadas condições”.
“É de facto uma estratégia de compromisso”, acrescenta Daniel Schreyer, coautor e antigo estudante de doutoramento na Universidade de Glasgow. “Dá origem a focos de células com níveis muito elevados de MYC, que promovem o desenvolvimento tumoral em certas condições, e de células com menos cópias, que podem ter melhor desempenho noutros ambientes – tudo no mesmo tumor”.
Esta flexibilidade sublinha a profunda heterogeneidade intratumoral caraterística do cancro do pâncreas, onde coexistem inúmeras subpopulações celulares que respondem de forma diferente ao tratamento. O tratamento de um subgrupo falha frequentemente contra outro, alimentando a resistência.
Uma das principais vantagens deste estudo é o facto de os organóides utilizados – mini-réplicas 3D de tumores pancreáticos cultivadas em laboratório – serem derivados directamente de doentes com doença em fase inicial. Estes organóides preservam grande parte da composição genética do tumor original, o que os torna excelentes plataformas de teste para o estudo do cancro. Ao contrário dos métodos que introduzem artificialmente o ADNec nas células, estes modelos laboratoriais reflectem as verdadeiras variantes de ADNec dos tumores reais.
“Esta abordagem oferece pistas sobre a dinâmica e a desorganização dos tumores”, diz Fiorini. “Dá-nos uma visão em primeira mão de que, mesmo quando dois doentes têm MYC no ADNec, a estrutura desse ADN circular pode diferir substancialmente, levando a grandes variações na expressão de MYC.”
Plasticidade em acção: organóides no laboratório
Para ver como o ADNec promove a adaptação das células tumorais, os investigadores cultivaram organóides derivados de doentes dos quais removeram sinais vitais de crescimento – tais como os chamados factores WNT – e, a seguir, observaram como estes organóides respondiam ao stress.
“Descobrimos que os organóides com MYC no ADN extracromossómico podiam alterar a sua dependência dos WNT”, explica Antonia Malinova, coautora e antiga aluna de doutoramento na Universidade de Verona. “Basicamente, as células com níveis elevados de ADNec tornaram-se mais auto-suficientes, deixando de precisar desses sinais externos para sobreviver”.
O estudo também revelou uma ligação clara entre níveis elevados de MYC e alterações na forma e no comportamento das células tumorais. Quando os níveis de MYC no ADNec dispararam, as células transformaram-se em estruturas mais agressivas e sólidas, perdendo a sua arquitectura mais organizada, semelhante à de uma glândula.
“O que é notável”, diz o coautor Vincenzo Corbo, da Universidade de Verona, ”é a rapidez com que estas cópias baseadas no ADNec podem aparecer ou desaparecer, dependendo do ambiente. Se o cancro estiver sob pressão – por exemplo, se faltarem factores de crescimento essenciais – as células com ADNec podem aumentar a expressão de MYC para sobreviver. Mas se a pressão for suprimida, elas podem perder alguns destes círculos de ADN adicionais para evitar as desvantagens de ter demasiadas cópias do oncogene.”
De facto, a expressão de MYC em níveis elevados pode provocar danos no ADN, obrigando as células cancerosas a equilibrar cuidadosamente os custos e os benefícios da retenção do ADNec. “Foi um resultado inesperado”, diz Corbo. “Desafia o pressuposto de que quanto mais MYC melhor para uma célula cancerosa – há um custo real em manter níveis tão elevados.”
O ADNec como alvo terapêutico?
Embora o ADN extracromossómico só apareça em cerca de 15% das amostras de doentes neste estudo, nesse subgrupo pode ser particularmente agressivo ou propenso à resistência aos tratamentos. Por isso, a detecção ou a perturbação do ADNec poderia abrir novas janelas terapêuticas.
“Podemos imaginar uma estratégia que explore as vulnerabilidades introduzidas pelo ADNec”, observa Corbo. “Talvez forçando as células cancerosas a aumentar os seus níveis de MYC até não conseguirem lidar com os danos no ADN, ou bloqueando os circuitos moleculares que mantêm estes anéis de ADN, fazendo com que as células os percam totalmente”.
No entanto, os autores alertam para o facto de estas ideias estarem ainda numa fase inicial. “O ADNec é uma faca de dois gumes: é útil para uma adaptação rápida, mas a sua manutenção tem um custo elevado”, diz Corbo. “O desafio é fazer pender essa balança a favor do doente”.
O que é fundamental é que este trabalho alarga a nossa compreensão da plasticidade genómica, desafiando a noção de que o genoma é sempre “fixo”. “Sabíamos que o meio envolvente do tumor poderiapode provocar alterações, mas não que a sinalização WNT pudesse reescrever o ADN de forma tão directa”, acrescenta Bailey. “Partimos do princípio de que veríamos sobretudo alterações epigenéticas, pelo que ver este nível de reengenharia genómica foi decididamente uma surpresa”.
E como se prevê que os casos de cancro do pâncreas aumentem nos próximos anos, a compreensão do papel do ADNec poderá orientar futuras estratégias para interceptar ou explorar esta caraterística genética, potencialmente tornando os tumores mais vulneráveis aos tratamentos.
Artigo original aqui.
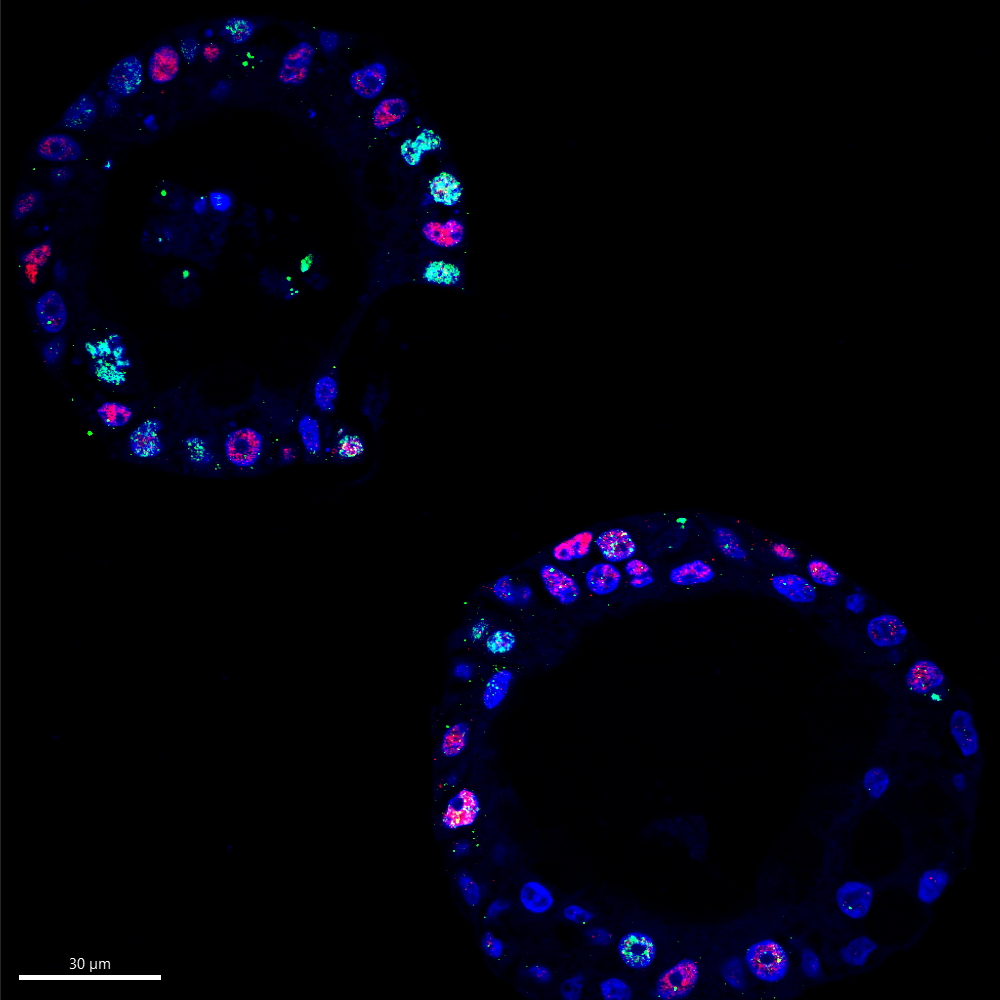
Legenda da Imagem: Imagens de imunofluorescência que mostram que as células com níveis mais elevados da proteína MYC, promotora do cancro (a vermelho), também tendem a apresentar níveis elevados de danos no ADN (a verde), o que sugere que um excesso de MYC conduz ao stress genómico.
Texto por Hedi Young, Science Writer e Content Developer da Equipa de Comunicação, Eventos e Outreach da Fundação Champalimaud.
Tradução por Ana Gerschenfeld, Health & Science Writer da Fundação Champalimaud.