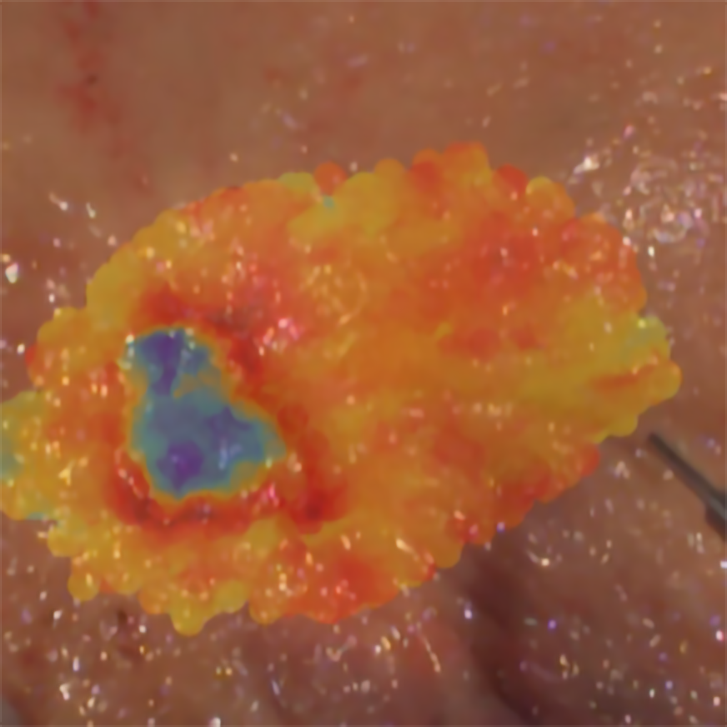
Sobre a bancada repousa uma parcela de intestino – aberto para se ter acesso à sua mucosa interior –, removido há instantes do abdómen de um doente com cancro do cólon. Um técnico pega num cabo de fibra óptica e começa a “varrer”, pairando por cima do espécime sem lhe tocar, a superfície deste com a ponta da fibra óptica. Nas zonas “varridas” pelo instrumento vão surgindo manchas de diversas cores, tal e qual como se o tecido estivesse a ser “pintado” pelo feixe laser que sai da fibra óptica.
Acontece que a luz laser faz naturalmente com que o tecido da amostra emita fluorescência. E que essa fluorescência contém informação crucial sobre o tumor que está a ser examinado. E assim, em poucos minutos, o técnico consegue pintar (em cores falsas, que correspondem a uma escala de valores numéricos) não só o tumor, mas também onde acabam as suas margens e começa o tecido saudável.
Um dia, num futuro não muito longínquo, acredita João Lagarto, engenheiro biomédico de 36 anos doutorado em biofotónica e coordenador da Plataforma de Biofotónica da Fundação Champalimaud, este mesmo procedimento de autêntica “pincelagem” poderá ser realizado in vivo, nos doentes, durante a cirurgia – antes de remover o tumor –, dando ao cirurgião a segurança de estar a retirar todo o tumor, sem deixar nada para trás e melhorando assim significativamente o prognóstico do doente.
João Lagarto chegou à Fundação Champalimaud em Setembro de 2020, onde começou por participar no chamado Programa Watch & Wait (W&W) [link artigo aqui], actualmente aplicado na Unidade do Digestivo a certos doentes com cancro rectal. “O nosso trabalho inicial foi focado na validação da nossa técnica para posterior implementação no programa W&W – daí estarmos agora a trabalhar com tecidos do cólon e reto”, explica. Mas o interesse da sua metodologia à base de fluorescência rapidamente se estendeu para outras aplicações com imenso potencial diagnóstico e terapêutico.
Por enquanto, João Lagarto e o seu colega Ignacio Herrando, cirurgião colorectal que faz a ponte entre a clínica e a Plataforma de Biofotónica, estão a dar os primeiros passos na validação desta “biópsia óptica”, analisando e “pintando” tecidos já extraídos dos doentes. E os seus primeiros resultados são muito promissores.
Explorar a fluorescência natural dos tecidos biológicos
Existem nos tecidos do corpo certas moléculas, chamadas fluoróforos que, quando estimuladas pela luz, emitem fluorescência. “Alguns fluoróforos têm funções muito específicas na bioquímica do tumor, que podem ser estudadas através da luz”, diz João Lagarto. Utilizando luz laser de várias cores e uma fibra óptica, estes investigadores conseguem assim captar, através de detectores sensíveis à luz (e via a mesma fibra óptica que envia a luz laser para o tecido) a fluorescência emitida pelos fluoróforos estimulados pelo laser. E dali extraem certas propriedades físicas dessa emissão, tais como a sua cor (verdadeira), intensidade e sobretudo o “tempo de vida” da fluorescência (o tempo que demora a declinar até desaparecer).
Mas o que tem isso a ver com cancro? “Estudos anteriores demonstraram que existe uma correlação entre esses tempos de vida da fluorescência e o processo canceroso”, responde João Lagarto.
A técnica que estes investigadores utilizam para medir os tempos de vida da fluorescência é uma técnica já utilizada, chamada TCSPC (time-correlated single-photon counting). “A originalidade aqui é que somos os únicos a usar esta técnica em ambiente hospitalar e em ambiente de alta luminosidade”, salienta João Lagarto.
Ora, a luminosidade intensa que reina num bloco operatório constitui, a priori, um enorme obstáculo à utilização de medições de fluorescência ao vivo e em directo, uma vez que a fluorescência emitida pelos fluoróforos dos tecidos é tipicamente muito fraca, explica João Lagarto. E acrescenta logo que não pode dar mais pormenores técnicos, em particular sobre como resolveram este problema, porque existem várias patentes pendentes relativas ao trabalho realizado.
Por outro lado, a luz dos lasers que a equipa utiliza é, quanto a ela, de baixa intensidade, o que evita danificar os tecidos escrutinados ou falsear a medição dos tempos de vida da fluorescência, problemas que poderiam acontecer com lasers mais potentes.
”O nosso objectivo é conseguir fazer a avaliação dos tecidos em endoscopias de diagnóstico com o nosso método, sobrepondo para isso as imagens de fluorescência às imagens endoscópicas”, prossegue o investigador. E, após o tratamento oncológico por quimioterapia ou radioterapia (ou a associação de ambos), queremos conseguir avaliar, também na endoscopia, o estado de recuperação do tecido”.
E durante uma cirurgia? “Neste momento trabalhamos só com espécimes acabados de extrair dos doentes e com tumores muito visíveis – antes de estes serem enviados para análise histopatológica”, diz João Lagarto. E como já foi referido, em dois a três minutos a equipa conseguiria dar feedback ao cirurgião sobre a localização e as margens do tumor.
A ser validado e integrado no protocolo cirúrgico para esta utilização, isso poderá significar um grande ganho de tempo de espera durante a cirurgia em relação à histopatologia. A análise histopatológica é hoje utilizada para identificar o tumor e apoiar a tomada de decisão do cirurgião, mas “é um procedimento demorado e cujo resultado pode não ser conclusivo. Assim, por vezes, não consegue dar resposta às necessidades da cirurgia”, diz João Lagarto. Todavia, até esta nova metodologia ser aprovada no bloco operatório, ainda há muito caminho a percorrer.
Mas é um facto que este procedimento experimental já está a dar bons resultados preliminares. “Até agora, comparámos as nossas imagens de medições de fluorescência do tecido extraído pelo cirurgião com as imagens de histopatologia do mesmo tecido em 29 doentes,” diz João Lagarto, “e em 24 casos fomos capazes de detectar o tumor. E dado que nos restantes casos não havia tumor [o que pode acontecer], isso significa que detectámos o tumor em 100% dos casos. Aliás, um dos aspectos mais interessantes é precisamente que, se não há tumor, o sinal da fluorescência dá-nos essa indicação.”
Por enquanto, porém, os cientistas não conseguem ainda identificar padrões muito específicos no conjunto extremamente complexo de sinais de fluorescência que recolhem – que é basicamente um emaranhado de cores emitidas simultaneamente por uma multiplicidade de fluoróforos, com tempos de vida muito variáveis, num processo que dura, no máximo, uns nanosegundos entre a chegada da luz laser ao tecido e o declínio da fluorescência resultante.
Mesmo assim, João Lagarto considera que, no futuro, com a ajuda da Inteligência Artificial e da aprendizagem automática (Machine Learning) será possível analisar mais minuciosamente as características dos dados obtidos, que ainda por cima variam segundo o órgão afectado pelo cancro e a cor do laser utilizado. “Este será um dos passos seguintes no processo de validação da nossa metodologia”, salienta.
Seja como for, o que interessa aqui em primeiro lugar é que os valores do tempo de vida da fluorescência (medidos em nanosegundos) que caracterizam um tecido anormal são diferentes dos que caracterizam um tecido saudável. “Quando existem inflamação, fibrose, ou um tumor, seja ele benigno ou maligno, as nossas medições detectam essas anomalias”, enfatiza João Lagarto. “Em particular, quando há um tumor, há sempre alguns desses valores que são diferentes daquilo que seriam num tecido saudável.”
A equipa já tem também em curso um protocolo com a Unidade de Ginecologia que visa a deteção precoce do cancro do endométrio durante a histeroscopia e um protocolo destinado à caracterização de quistos do pâncreas e de lesões pré-cancerosas do pâncreas. Este segundo protocolo será realizado no novo Botton-Champalimaud Pancreatic Cancer Centre. “Trabalhamos em colaboração com as Unidades clínicas e o serviço de patologia. O nosso objectivo é servir os clínicos e os doentes”, diz João Lagarto.
E quando é que o cientista acha que o seu método poderá ser utilizado in vivo no bloco operatório? “Espero que até ao final de 2023 tenhamos o primeiro case-study, in vivo, em cirurgia aberta”, responde João Lagarto. “Quanto à cirurgia laparóscopica/robótica, será preciso mais um tempo: dois a três anos pelo menos. Porque nesse casos, vai ser preciso fazer a integração da nossa abordagem com os equipamentos clínicos existentes.”
Legenda da imagem
Imagem de fluorescência obtida pela equipa na qual o tumor (do cólon) aparece em tons azuis. No canto inferior direito vê-se a ponta do dispositivo de fibra óptica com que é feito o varrimento.
Crédito da imagem
João Lagarto e Ignacio Herrando
Texto por Ana Gerschenfeld, Health & Science Writer da Fundação Champalimaud.